Рассчитайте рН раствора, образованного смешиванием равных объемов децимолярных растворов азотной и фтороводородной кислот
Рассчитайте рН раствора, образованного смешиванием равных объемов децимолярных растворов азотной и фтороводородной кислот. Ka(HF)=6,8·10-4 моль/л.
Решение
При смешивании растворов объем увеличился вдвое, следовательно, концентрации вдвое уменьшились. Считаем:
C0(HNO3)=0,05 моль/л;
C0(НF)=0,05 моль/л.
Азотная кислота - сильный электролит и в растворе полностью диссоциирует. Фтороводородная (плавиковая) кислота-слабый электролит:
HF⇔H++F-; Ka=6,8·10-4
Существенно, что в присутствии сильной кислоты равновесие диссоциации HF практически нацело сдвинуто влево (nринцип Ле Шателье), и можно считать, что в этом случае [H+]= c(HNO3).
Тогда pH=-lg[Н+]=-lg0,05=1,3.
Последнее утверждение несложно проверить. Допустим, продиссоциировало
х моль/л HF. Тогда [HF]=0,05-x; [F-]=x, а [Н+]=0,05+х.
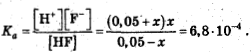
Откуда х=6,8·10-4-2

