При сгорании 2,3 г органического вещества в избытке кислорода образуется 4,4 г диоксида углерода и 2,7 г воды
При сгорании 2,3 г органического вещества в избытке кислорода образуется 4,4 г диоксида углерода и 2,7 г воды. Относительная плотность паров этого вещества по водороду равна 23. Из каких элементов состоит вещество? Определите его формулу.
Решение
Органическое вещество, содержащее С, Н и О, при сгорании образует СО2 и Н9О. Поэтому предполагаемая формула вещества: СaНbОc.
Расчет нижних индексов:
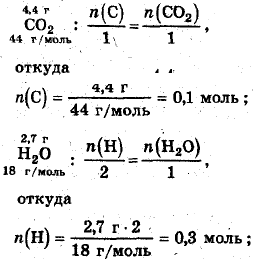
Мacca углерода в СaНbOc
0,1 моль·12 г/моль= 1,2 г;
масса водорода
0,3 моль· 1 г/моль= 0,3 г масса кислорода
2,3 г - 1,2 r - 0,3 г = 0,8 г;
количество вещества кислорода
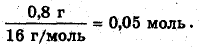
а:b:с=n(C):n(H):n(O)=0,1:0,3:0,05=2:6:1, следовательно, эмпирическая формула: С2Н6O Расчет молярной массы по относительной плотности:
М(СaНbОc)=23·2 г/моль=46 г/моль;
по эмпирической формуле: M(С2Н6O) = 46 г/моль Истинная и эмпирическая формулы вещества одинаковы: С2Н6О

