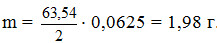На угольном аноде выделилось 350 мл кислорода при нормальных условиях. Сколько граммов меди выделилось на катоде
При электролизе раствора CuSO4 на угольном аноде выделилось 350 мл кислорода при нормальных условиях. Сколько граммов меди выделилось на катоде? Приведите уравнения электродных процессов, определите продукты электролиза.
Решение. В водном растворе сульфат меди(II) диссоциирует по схеме: CuSO4 = Cu2+ + SO42-. Электродный потенциал меди (+0,337 В) значительно больше потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде происходит процесс восстановления ионов Cu2+. При электролизе водных растворов сульфат-анионы не окисляются на аноде. На нем происходит окисление воды.
Катод ← Cu2+, Н2О Анод ← SO42–, Н2О
На катоде: Cu2+ + 2e- = Сu На аноде: 2Н2О – 4e- = 4Н+ + О2.
Продукты электролиза – Сu и О2.
У анода: 4Н+ + 2SO42– = 2Н2SO4
Один моль эквивалентов кислорода при н.у. занимает объем 5,6 л. Следовательно, 350 мл составляют 0,35 / 5,6 = 0,0625 моль. Столько же молей эквивалентов выделилось на катоде. Отсюда, масса меди