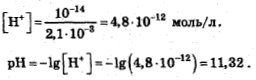Рассчитайте рН раствора, полученного при растворении 16,8 л аммиака
Условие:
Рассчитайте рН раствора, полученного при растворении 16,8 л аммиака (н. у.) в воде, если объем полученного раствора составил 3 литра.
NH3+Н2O⇔NH4++ОH-, Кb=1,84·10-5 моль/л
Решение
Находим молярную концентрацию аммиака. Количество вещества
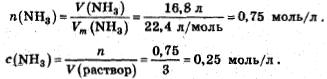
Уравнение реакции электролитической диссоциации:
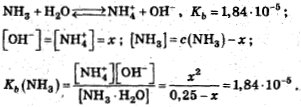
Предполагаем: х
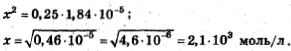
Проверяем: 2, 1·10-3-1
Нашли, что [OH-]=2,1·10-3
Концентрация ионов водорода и гидроксид-ионов связаны соотношением:
[H+][OH-]=Kw,
где Kw-ионное произведение воды. Это постоянная при данной температуре величина. Для 25 °С
Kw=10-14 моль/л.
Из этого соотношения
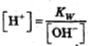
находим