При сжигании 1,64 г неизвестного органического вещества в избытке кислорода получили 1,12 л углекислого газа, 1,26 мл воды
При сжигании 1,64 г неизвестного органического вещества в избытке кислорода получили 1,12 л углекислого газа, 1,26 мл воды (объемы приведены к н. у.), а в трубке для сжигания осталось 1,06 г несгораемого остатка, представляющего собой карбонат натрия. Выскажите предположения о строении органического вещества.
Решение
По продуктам сгорания можно предположить следующую формулу вещества: CaHbOcNadОпределение нижних индексов:
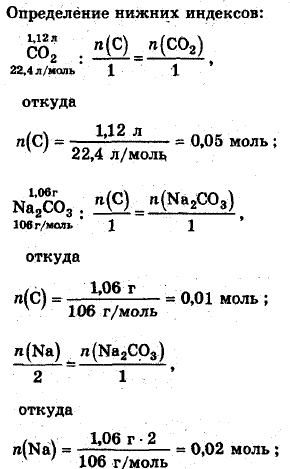
Масса углерода в CaHbOcNad
0,06 моль·12 г/моль = 0,72 г;
масса водорода
0,14 моль·1 г/моль = 0,14 г;
масса натрия
0,02 моль·28 г/моль = 0,46 г;
масса кислорода
1,64 г- 0,72 г- 0,14 г- 0,46 г=0,82 (г);
количество вещества кислорода
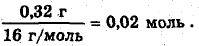
а:b:с:d =n(C):n(H):n(O):n(Na)=0,06:0,14:0,02:0,02=8:7:1:1.
Формула вещества: C3H7ONa (пропилат натрия).

