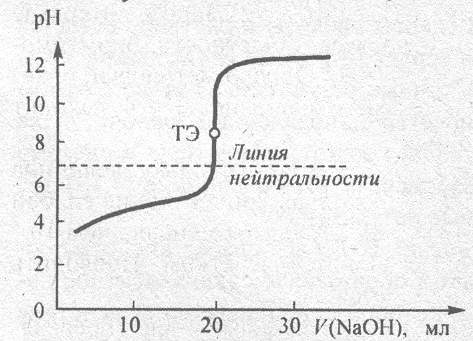
Построить кривую титрования раствора уксусной кислоты раствором гидроксида натрия
Построить кривую титрования 100,0 мл раствора уксусной кислоты СH3СООН с молярной концентрацией эквивалента C(1/z)=0,1 моль/л раствором гидроксида натрия NaOH с молярной концентрацией эквивалента C(1/z)=0,1 моль/л.
1 этап – до точки эквивалентности
Расчет кривой титрования начинают с расчета рН исходного раствора. Пусть добавлено 0 мл раствора NaOH. Уксусная кислота СH3СООН – слабая кислота и в растворе она диссоциирует частично:
СH3СООН ⇔ СH3СОО- + Н+
Согласно закону действующих масс, напишем уравнение для вычисления константы ионизации уксусной кислоты:
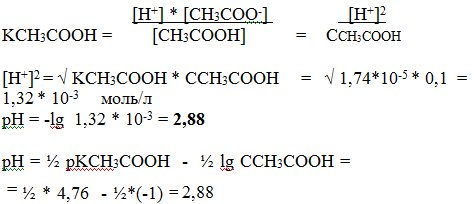
При добавлении к уксусной кислоте СH3СООН раствора гидроксида натрия NaOH, образуется эквивалентное количество ацетата натрия СH3СООNa. Протекает реакция:
СH3СООН + NaOH ⇔ СH3СООNa + Н2О
Смесь ацетат натрия и уксусной кислоты – это ацетатный буферный раствор. рН до точки эквивалентности рассчитывают по формуле:
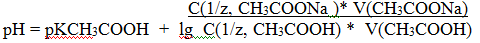
1) Добавлено 10,0 мл раствора NaOH, образуется эквивалентное количество СH3СООNa.
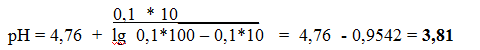
2) Добавлено 50,0 мл раствора NaOH.
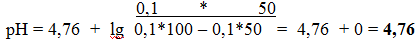
3 )Добавлено 90,0 мл раствора NaOH
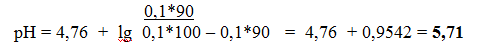
4) Добавлено 99,0 мл раствора NaOH
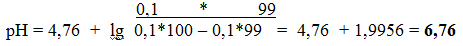
5) Добавлено 99,9 мл раствора NaOH
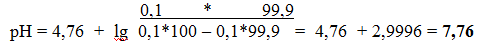
2 этап – точка эквивалентности
2.1) Добавлено 100,0 мл раствора NaOH. В этот момент уксусная кислота СH3СООН полностью прореагирует с гидроксидом натрия NaOH. В растворе будут присутствовать соль – ацетат натрия СH3СООNa и вода. Ацетат натрия - это соль, которая образована сильным основанием (NaOH) и слабой кислотой (СH3СООН). Она будет подвергаться гидролизу по аниону:
СH3СОО- + НОН ⇔ СH3СООН + ОН-
рН раствора рассчитывают по формуле:
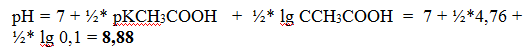
3 этап – после точки эквивалентности
рН раствора будет определяться количеством добавленной щелочи. Концентрация ОН- - ионов растет пропорционально количеству добавленного NaOH. Гидроксид натрия NaOH – сильное основание и в растворе диссоциирует полностью:
NaOH ⇔ Na+ + ОН-
3.1) Добавлено 100,1 мл раствора NaOH. Избыток щелочи будет 100,1 – 100 = 0,1 мл.
Концентрация NaOH и [ОH-] будет:
(0,1*0,1)/(100+100,1)= 0,01 / 200,1 = 0,0000499 моль/л
рОН = - lg 4,99 * 10-5 = 5 – 0,6981 = 4,3019
рН = 14 – 4,3019 = 9,6981 = 9,70
3.2) Добавлено 101,0 мл раствора NaOH. Избыток щелочи будет 101 – 100 = 1 мл.
Концентрация NaOH и [ОH-] будет: (1*0,1)/(100+101)= 0,1 / 201 = 0,0004975 моль/л
[ОH-] = 4,98 * 10-4 моль/л
рОН = - lg 4,98 * 10-4 = 4 – 0,6972 = 3,3028
рН = 14 –3,3028 = 10,6972 = 10,70
3.3) Добавлено 110,0 мл раствора NaOH. Избыток щелочи будет 110 – 100 = 10 мл.
Концентрация NaOH и [ОH-] будет:
(10*0,1)/(100+110)= 1 / 210 = 0,00476 моль/л
[ОH-] = 4,76 * 10-3 моль/л
рОН = - lg 4,76 * 10-3 = 3 – 0,6776 = 2,3224
рН = 14 - 2,3224 = 11,6776 = 11,68
3.4) Добавлено 200,0 мл раствора NaOH. Избыток щелочи будет 200 – 100 =100 мл.
Концентрация NaOH и [ОH-] будет: (100*0,1)/(100+200)= 10 / 300 = 0,0333 моль/л
[ОH-] = 3,33 * 10-2 моль/л
рОН = - lg 3,33 * 10-2 = 2 – 0,5224 = 1,4776
рН = 14 – 1,4776 = 12,5224 = 12,52
Полученные данные помещаем в таблицу
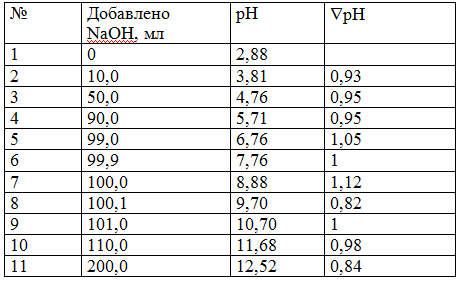
Строим график в координатах: ось у (ординат ) – значения рН; ось х (абсцисс – объем добавленного NaOH , мл.