На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода
На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода (н. у.). Вычислите молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла?
Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться формулой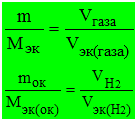
Напомним, что объем 1 моль эквивалентов водорода равен 11,2 л (н. у.), тогда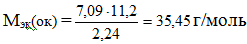
Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение металла с кислородом, поэтому молярная масса эквивалентов оксида представляет собой сумму Мэк (оксида) = Мэк (металла) + Мэк (кислорода).
Отсюда, Мэк (металла) = Мэк (оксида) – Мэк (кислорода) = 35,45 – 8 = 27,45 г/моль.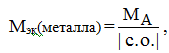
отсюда МА = Мэк(металла)*с.о. = 27,45*2 = 54,9 г/моль.
Таким образом, Мэк(оксида) = 35,45 г/моль; Мэк (металла) = 27,45 г/моль; МА(металла) = 54,9 г/моль

