Как изменится степень диссоциации уксусной кислоты концентрации с = 0,1 моль/л при добавлении к 1 л раствора кислоты 0,01 моль ацетата натрия
Условие:
Как изменится степень диссоциации уксусной кислоты концентрации с = 0,1 моль/л при добавлении к 1 л раствора кислоты 0,01 моль ацетата натрия? Константа диссоциации СН3СООН равна 1,8·10-5моль/л.
Решение
СН3СООН↔H++СН3COO-;
K=1,8·10-11 моль/л,
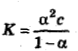
и так как α=
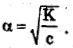
До прибавления соли ацетата натрия:
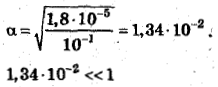
После прибавления CH3COONa определяем степень диссоциации:
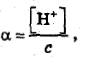
Тогда
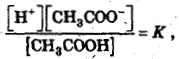
отсюда
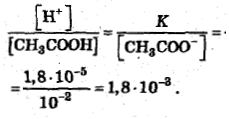
В присутствии соли диссоциация кислоты становится еще менее значительной, и можно определенно полагать:
[СН3СООН]=с(СН3СООН)
и [СН3СОО-]=c(CH3COONa).
категории:

