К 400 мл смеси некоторого углеводорода с азотом добавили 900 мл (избыток) кислорода и подожгли
К 400 мл смеси некоторого углеводорода с азотом добавили 900 мл (избыток) кислорода и подожгли. Объем полученной после сгорания смеси составил 1,4 л, а после конденсации паров воды сократился до 800 мл. Новое сокращение объема до 400 мл наблюдалось в результате пропускания газов через раствор гидроксида калия. Объемы измерялись при одинаковых условиях. Установить формулу углеводорода.
Решение
Из условия задачи следует, что после сгорания углеводорода СxНy (азот не реагирует с кислородом при сжигании) образуется 600 мл водяных паров и 400 мл углекислого газа. Остается избыточное количество кислорода и непрореагировавший азот. Объем этих газов 400 мл. Реакция горения углеводорода идет согласно схеме
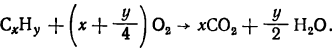
Заменив соотношение объемов полученных продуктов СO2 и Н2O (400:600) соотношением числа их молекул (4:6), получим
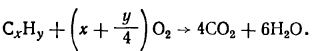
Соотношение количества образующихся молекул углекислого газа и водяных паров и получающееся из них соотношение атомов углерода и водорода (1:3) позволяют говорить о том, что простейшая формула углеводорода СН3. Для определения истинной формулы необходимо знать, из какого количества молекул СxНy образуются
4 молекулы углекислого газа и 6 молекул воды, т. е. объем сжигаемого углеводорода. Найти его можно, если узнать объем прореагировавшего кислорода. Из схемы реакции следует, что в реакцию вступает 7 молекул кислорода, или, если вернуться к исходному соотношению объемов, -700 мл. Тогда после сгорания остается 200 мл (900-700) кислорода и 200 мл (400-200) азота. В исходной смеси было 200 мл (400—200) углеводорода. Запишем еще раз схему протекающего при горении процесса:
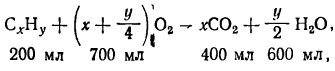
откуда уравнение реакции
2СxНy + 7O2 = 4СO2+6Н2O
и х=2, y=6. Формула углеводорода С2Н6.

