Составьте уравнение окислительно-восстановительной реакции, идущей по схеме
Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: KMnO4+ KNO2+H2SO4 = MnSO4+ KNO3 +K2SO4+H2O
Определите окислитель и восстановитель. На основании электронных уравнений расставьте коэффициенты.
Решение:
Определяем степени окисления тех элементов, которые ее изменяют:
KMn+7O4+ KN+3O2+H2SO4 = Mn+2SO4+ KN+5O3 +K2SO4+H2O
Составляем электронные уравнения процессов окисления и восстановления, определяем окислитель и восстановитель: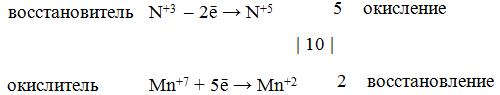
Уравниваем реакцию методом электронного баланса, суть которого заключается в том, что общее число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Находим общее наименьшее кратное для отданных и принятых электронов. В приведенной реакции оно равно 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свои степени окисления, находим подбором. Уравнение реакции будет иметь вид:
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O

