Составьте электронно-точечные формулы молекул
Составьте электронно-точечные формулы молекул: HF, Н2O, NH3 и СН4. Определите для каждого атома число неnоделенных nap. Покажите, что эти молекулы являются изоэлектронными.
Решение
Схематическое описание ковалентных связей в химических соединениях при помощи формул, в которых валентные электроны изображаются точками, было предложено Дж. Льюисом. Для молекул типа ABn, где А - центральный атом, В - присоединенный атом, n-число атомов В, сначала изображают электронно-точечную формулу центрального атома А, например:
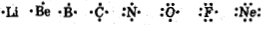
Затем к центральному атому А присоединяют связанные с ним атомы В так, чтобы между ними образовалась общая: электронная пара. Согласно правилу октета каждому элементу второго периода требуется: для создания устойчивой электронной конфигурации восемь валентных электронов. В силу этого центральный атом в молекулах типа АВn должен быть окружен восемью электронами:
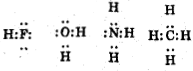
Неподеленные пары: F-3 O-2 N-1 С- нет. Молекулы с одинаковым. числом валентных электронов называют электронными. HF, H2, NH3 и СН4 - изоэлектронные молекулы.

