Сколько граммов никеля выделится на катоде при пропускании через раствор сернокислого никеля NiSO4 тока силой 5 А в течение 10 мин
Сколько граммов никеля выделится на катоде при пропускании через раствор сернокислого никеля NiSO4 тока силой 5 А в течение 10 мин? Приведите схемы электродных процессов, протекающих при электролизе с инертным анодом. Определите продукты электролиза.
Решение. В водном растворе сульфат никеля (II) диссоциирует:
NiSO4 = Ni2+ + SO42–. Стандартный электродный потенциал никеля (–0,250 В) выше значения потенциала восстановления ионов водорода из воды (–0,41 В). Поэтому на катоде будет происходить разряд ионов Ni2+ и выделение металлического никеля. При электролизе сернокислых солей на инертном аноде происходит электрохимическое окисление воды с выделением кислорода.
Катод: Ni2+, Н2О Анод: SO42–, Н2О
На катоде: Ni2+ + 2e- = Ni На аноде: 2Н2О – 4e- = 4Н+ + О2
Продукты электролиза – Ni и О2,
У анода: 4Н+ + 2SO42– = 2Н2SO4
Молярная масса эквивалентов никеля (мол. масса атомов – 58,71 г/моль) равняется 58,71 / 2 = 29,36 г/моль. Подставляя это значение, а также силу тока и время электролиза (в секундах) в формулу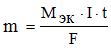
получаем искомую массу никеля: m = (29,36 · 5 · 600) / 96500 = 0,91 г

