При некоторой температуре в системе равновесные концентрации составляли
При некоторой температуре в системе N2(г) + 3Н2(г) ↔ 2NH3(г)
равновесные концентрации составляли (моль/л): [N2]= 1,5; [H2] = 1,7; [NH3] = 2,6.
Вычислите константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение. Константа равновесия данной реакции выражается уравнением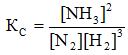
Подставляя данные задачи, получаем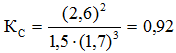
Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N2. По условию задачи образовалось 2,6 моль NH3, на что израсходовалось 1,3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию С(N2) = 1,5 + 1,3 = 2,8 моль/л.
По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2,6 моль NH3 требуется 3·2,6 / 2 = 3,9 моль H2. Исходная концентрация водорода равна С(Н2) = 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92, исходные концентрации составляли С(N2) = 2,8 моль/л, С(H2) = 5,6 моль/л.

