Предскажите геометрическую форму молекул
Предскажите геометрическую форму следующих молекул:
- а) BeCI2;
- б) BF3 , SnCl2;
- в) СН4; NH3, Н2O
Изобразите структурные формулы молекул с учетом их геометрии.
Решение
Для упомянутых в задаче молекул можно предложить общую формулу АВnЕm, где А - центральный атом, В - связанный с ним атом или лиганд, Е - неподеленная пара, n - число присоединенных атомов, m - число неподеленных пар центрального атома. Предсказать геометрическую форму молекул такого типа можно на основе метода отталкивания валентных электронных пар Гиллеспи - Найхолма. Перечислим основные положения метода.
- центральный атом А образует единую валентную оболочку, на которую поступают все валентные электроны центрального атома А и только те электроны атомов В, которые участвуют в образовании химической связи.
- Электроны валентной оболочке образуют электронные пары, которые располагаются так, чтобы отталкивание между ними было как можно меньше, а следовательно, расстояние - как можно больше.
- Геометрическая форма молекулы определяется числом электронных пар на валентной оболочке.
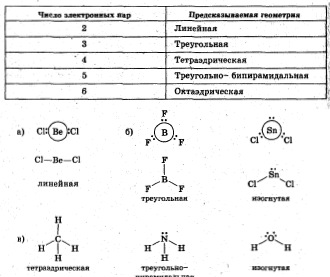
Неподеленные пары находятся ближе к центральному атому, чем связывающие, и поэтому сильнее их отталкивают. В силу этого валентньй угол в молекуле SnCl2 меньше, чем 120°. Валентные углы: ВеСl2 - 180°, BF- 120° SnCl2- 104,5° СН4 109,5°, NH3- 107,3° , Н2O - 104,5°.

