Основные положения теории кислот и оснований
Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Иначе говоря, кислота является донором, а основание акцептором протонов.
Существуют также вещества, способные как отдавать, так и принимать протоны; они называются амфолитами. Кислотами могут быть молекулы (НСl, HCN), катионы (NH4+, Al(H2O)63+, анионы (НСО3-, Н2РО4-). Основания также могут быть нейтральными (NH3, (СН2)6N4, C5H5N), положительно заряженными (Al(H2O)5OH2+) и отрицательно заряженными (НРО42-, Н2РО4-, HS-). Амфолитами могут быть и заряженные (НРО42-, Н2РО4-, Al(H2O)5OH2+) и нейтральные (Н2О, NH3 , C5H5OH, СН3СООН) частицы.
Вследствие малого размера протон обладает высокой поляризующей способностью и не может существовать в растворах в свободном виде. Поэтому реакцию диссоциации кислоты НА следует записывать так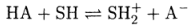
Здесь SH —растворитель, проявляющий свойства основания (акцептор протонов). Аналогично можно записать и реакцию диссоциации основания В: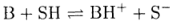
Здесь растворитель проявляет свойства донора протонов, т. е. кислоты. Диссоциация заряженной кислоты, например NH4+, описывается уравнением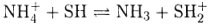
Аналогично для заряженного основания, например СНзСОO-, следует записать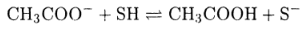
Нетрудно видеть, что если растворителем является вода, то эти реакции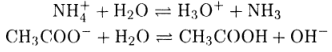
в рамках теории Аррениуса называются реакциями гидролиза. Следовательно, гидролиз есть частный случай кислотно-основного равновесия и представляет собой реакцию диссоциации заряженных кислот и оснований в воде. Константу взаимодействия кислоты НА с растворителем SH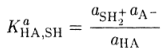
называют константой диссоциации кислоты НА (константой кислотности). В достаточно разбавленных растворах α(SH2+) -постоянная величина и практически не отличается от активности чистого растворителя, поэтому она включается в величину константы равновесия. Аналогично константу равновесия реакции взаимодействия основания В с растворителем SH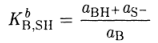
называют константой диссоциации основания (константой основности).
Совершенно очевидно, что сила кислоты или основания в значительной степени зависит от кислотно-основных свойств растворителя. Чем более сильным основанием является растворитель, тем в большей степени диссоциируют в нем кислоты и тем в меньшей степени — основания. Наоборот, растворители с ярко выраженными кислотными свойствами усиливают диссоциацию оснований и подавляют диссоциацию кислот. Если при этом по «собственной» силе рассматриваемые кислоты (или основания) не слишком различаются, то растворитель с достаточно выраженными кислотными свойствами (протогенный) нивелирует эти различия у этих растворенных в нем оснований, но отчетливо дифференцирует кислоты. Наоборот, растворитель с хорошо выраженными основными свойствами (протофильный) нивелирует силу таких кислот и дифференцирует основания. В любом растворителе самой сильной кислотой является сольватированный протон - ион лиония, а самым сильным основанием — ион лиата.

