Кривая титрования сильного основания сильной кислотой
Для построения кривой титрования рассчитывают значения рН:
- до точки эквивалентности;
- в точке эквивалентности;
- после точки эквивалентности.
Кривая титрования сильного основания сильной кислотой
Задача: Построить кривую титрования 100,0 мл раствора гидроксида натрия NaOH с молярной концентрацией эквивалента C(1/z)=0,1 моль/л раствором хлороводородной кислоты HCl с молярной концентрацией эквивалента C(1/z)=0,1 моль/л.
1 этап – до точки эквивалентности
Расчет кривой титрования начинают с расчета рН исходного раствора.
1.1 Пусть добавлено 0 мл раствора HCl. Гидроксид натрия NaOH – сильное основание и в растворе диссоциирует полностью:
NaOH ⇔ Na+ + ОН-
Так как NaOH – бинарное соединение, то концентрация гидроксил-ионов равна молярной концентрации гидроксида натрия:
[OH-] = C(NaOH)
Так как z = 1, то C(1/z, NaOH) = C( NaOH) = 0,1 = 10-1 моль/л
рОН = - lg10-1 = 1
Ионное произведение воды равно рН + рОН = 14, отсюда
рН = 14 – рОН = 14-1 = 13,0
Значения рН раствора до точки эквивалентности определяется концентрацией не оттитрованного гидроксида натрия.
1.2 Добавлено 10,0 мл раствора HCl. В растворе протекает реакция нейтрализации:
NaOH + HCl ⇔ NaCl + Н2О
Определяем, сколько NaOH вступило в реакцию и сколько NaOH осталось в растворе. По закону эквивалентов:
С(1/z, NaOH) * V (NaOH) = С(1/z, HCl) * V (HCl)
С(1/z, HCl) * V (HCl) = 0,1 * 10
V (NaOH) = С(1/z, NaOH) = 0,1 = 10 мл NaOH
израсходовано (вступило в реакцию); осталось NaOH (100 - 10) = 90 мл. Концентрация NaOH уменьшилась. Определяем новую концентрацию NaOH, учитывая разбавление раствора:
С(NaOH) = (90 * 0,1) / (100 + 10) = 9 / 110 = 0,0818 моль/л
[OH-] = 8,18 * 10-2 моль/л
рОН = - lg8,18*10-2 = 2 – 0,9128 = 1,0872
рН = 14 – 1,0872 = 12,9128 = 12,91
1.3 Добавлено 50,0 мл раствора HCl. В реакцию вступило NaOH (0,1*50)/0,1 = 50,0 мл. Осталось в растворе NaOH (100 - 50) = 50,0 мл. Новая концентрация NaOH :
С(NaOH) = (50 * 0,1) / (100 + 50) = 5 / 150 = 0,0333 моль/л
[OH-] = 3,33 * 10-2 моль/л
рОН = - lg 3,33 * 10-2 = 2 – 0,5224 = 1,4776
рН = 14 – 1,4776 = 12,5224 = 12,52
1.4 Добавлено 90,0 мл раствора HCl. В реакцию вступило NaOH (0,1*90)/0,1 = 90,0 мл. Осталось в растворе NaOH (100 - 90) = 10,0 мл. Новая концентрация NaOH :
С(NaOH) = (10 * 0,1) / (100 + 90) = 1 / 190 = 0,00526 моль/л
[OH-] = 5,26 * 10-3 моль/л
рОН = - lg 5,26 * 10-3 = 3 – 0,7210 = 2,279
рН = 14 – 2,279 = 11,721 = 11,72
1.5 Добавлено 99,0 мл раствора HCl. В реакцию вступило NaOH (0,1*99)/0,1 = 99,0 мл. Осталось в растворе NaOH (100 - 99) = 1 мл. Новая концентрация NaOH :
С(NaOH) = (1 * 0,1) / (100 + 99) = 0,1 / 199 = 0,0005025 моль/л
[OH-] = 5,03 * 10-4 моль/л
рОН = - lg 5,03 * 10-4 = 4 – 0,7016 = 3,2984
рН = 14 – 3,2984 = 10,7016 = 10,70
1.6 Добавлено 99,9 мл раствора HCl. В реакцию вступило NaOH (0,1*99,9)/0,1 = 99,9 мл. Осталось в растворе NaOH (100 – 99,9) = 0,1 мл. Новая концентрация NaOH :
С(NaOH) = (0,1 * 0,1) / (100 + 99,9) = 0,01 / 199,9 = 0,00005 моль/л
[OH-] = 5 * 10-5 моль/л
рОН = - lg 5 * 10-5 = 5 – 0,6990 = 4,301
рН = 14 – 4,301 = 9,699 = 9,70
2 этап – точка эквивалентности
Добавлено 100,0 мл раствора HCl. В этот момент NaOH полностью (весь) прореагирует с кислотой HCl. В растворе будут присутствовать соль – хлорид натрия NaCl и вода. Хлорид натрия не подвергается гидролизу, потому, что образована сильным основанием (NaOH) и сильной кислотой (HCl). рН раствора будет определяться автопротолизом воды:
Kw = [H+] * [OH-] = 10-14
[H+] = [OH-]*[H+] = √Kw = √10-14 = 10-7
рН = - lg10-7 = 7,0
3 этап – после точки эквивалентности
рН раствора будет определяться количеством добавленной кислоты. Концентрация Н+ - ионов растет пропорционально количеству добавленной HCl. Хлороводородная кислота - сильная, в растворе она диссоциирует полностью:
HCl ⇔ Н+ + Cl-
Концентрация Н+ - ионов равна молярной концентрации HCl.
3.1 Добавлено 100,1 мл раствора HCl. Избыток кислоты будет 100,1 – 100 = 0,1 мл.
Концентрация хлороводородной кислоты:
С(HCl)= (0,1*0,1)/(100+100,1)= 0,01 / 200,1 = 0,0000499 моль/л
[H+] = 4,99 * 10-5 моль/л
рН = - lg 4,99 * 10-5 = 5 – 0,6981 = 4,3019 = 4,30
3.2 Добавлено 101,0 мл раствора HCl.
Избыток кислоты будет
101 – 100 = 1 мл.
Концентрация хлороводородной кислоты:
С(HCl)= (1*0,1)/(100+101)= 0,1 / 201 = 0,0004975 моль/л
[H+] = 4,98 * 10-4 моль/л
рН = - lg 4,98 * 10-4 = 4 – 0,6972 = 3,3028 = 3,30
3.3 Добавлено 110,0 мл раствора HCl.
Избыток кислоты будет 110 – 100 = 10 мл.
Концентрация хлороводородной кислоты:
С(HCl)= (10*0,1)/(100+110)= 1 / 210 = 0,00476 моль/л
[H+] = 4,76 * 10-3 моль/л
рН = - lg 4,76 * 10-3 = 3 – 0,6776 = 2,3224 = 2,32
3.4 Добавлено 200,0 мл раствора HCl.
Избыток кислоты будет 200 – 100 =100 мл.
Концентрация хлороводородной кислоты: С(HCl)= (100*0,1)/(100+200)= 10 / 300 = 0,0333 моль/л
[H+] = 3,33 * 10-2 моль/л
рН = - lg 3,33 * 10-2 = 2 – 0,5224 = 1,4776 = 1,48
Полученные данные помещаем в таблицу.
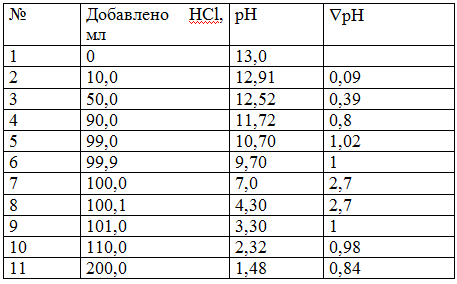
Строим график в координатах: ось у (ординат ) – значения рН; ось х (абсцисс – объем добавленной HCl, мл.
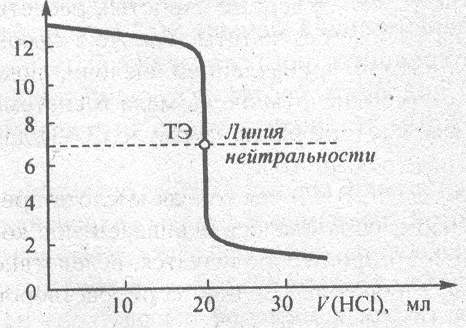
Прямая параллельная оси х и при рН = 7, пересекающая ось у – называют линией нейтральности. В начале титрования рН изменяется очень медленно. Если оттитровать половину (50 %) гидроксида натрия, то рН раствора изменится на 0,48 единиц (рН 13 – 12,52 = 0,48). Затем рН раствора изменяется более резко. Титрование последнего 0,1 мл NaOH изменяет рН на 2,7 единицы. Добавление избытка кислоты в 0,1 мл также изменяет рН раствора на 2,7 единицы.
Резкое изменение рН в области точки эквивалентности называют скачком титрования. Это наиболее важная часть кривой титрования, так как по ней производят выбор индикатора. Интервал перехода индикатора должен входить или захватывать скачок титрования. В данном случае при титровании сильного основания сильной кислотой скачок титрования большой – (9,7 – 4,3) = 5,4 единицы рН. В качестве индикаторов можно использовать: метилоранж (3,1 – 4,4; рТ = 4), метиловый красный (4,2 – 6,2; рТ= 5), фенолфталеин (8,2-10; рТ=9).
Прямую, параллельную оси абсцисс и при рН 7,0 пересекающую ось ординат, называют линией нейтральности.
Прямую, параллельную оси ординат и пересекающую ось абсцисс при V (NaOH) = 100,0 мл, называют линией эквивалентности. Левее этой прямой находится раствор, содержащий избыток кислоты, правее – раствор, содержащий избыток щелочи.
Точку пересечения кривой титрования с линией эквивалентности называют точкой эквивалентности, а точку пересечения кривой титрования с линией нейтральности называют точкой нейтральности. При титровании сильной кислоты сильным основанием точка эквивалентности и точка нейтральности совпадают.

